تقنية جديدة تستخدم الذكاء الاصطناعي في تعديل الجينات ‘دون أخطاء’
أعلن فريق بحثي في جامعة زيورخ السويسرية، تطوير تقنية جديدة تجمع بين أدوات الهندسة الوراثية المتقدمة والذكاء الاصطناعي، بهدف تحقيق دقة غير مسبوقة في تعديل الحمض النووي، مما يمهد الطريق لعلاجات جينية أكثر أماناً وفعالية للأمراض المستعصية.
تعتمد التقنية على أداة تحمل اسم “بيثيا” صُممت للتنبؤ بكيفية إصلاح الخلايا لحمضها النووي بعد قطعه باستخدام أدوات مثل “كريسبر كاس 9” وهو ما يقلل من الأخطاء الجينية غير المقصودة ويحافظ على سلامة الجينوم.
ويقول الباحث الرئيسي، توماس نيرت، الذي ابتكر هذه التقنية في جامعة زيورخ، ويعمل حالياً في جامعة جينت البلجيكية: “قمنا بتطوير قوالب صغيرة لإصلاح الحمض النووي تعمل كـ”غراء جزيئي” لتوجيه الخلية نحو تعديل جيني دقيق.
وتعمل “بيثيا” بتكامل متقن مع تقنيات التعديل الجيني مثل “تقنية كريسبر” عبر آلية دقيقة وذكية لتوجيه الخلايا نحو إصلاحات جينية محددة. فعند استخدام “كريسبر” لقصّ شريط الحمض النووي، تترك هذه العملية “جروحا” تتطلب إصلاحاً من قبل الخلية، وعادة ما تتبع الأنماط الطبيعية للإصلاح؛ لكنها قد تؤدي إلى أخطاء جينية غير مقصودة.
وبحسب الدراسة المنشورة في دورية نيتشر بايوتكنولوجي، فإن دور “بيثيا”، يتمثل في استخدام نماذج تعلم عميق للتنبؤ بكيفية إصلاح الخلية لهذا القطع، استناداً إلى آلاف البيانات السابقة، وتقدّر بدقة “القوالب الجزيئية” الأنسب التي ترشد الخلية نحو إدخال التغيير المرغوب دون إحداث ضرر عرضي.
وصمم الفريق البحثي، سلاسل قصيرة من قواعد الحمض النووي، تُعرف بـ أذرع إصلاح مكرّرة ثلاثية القواعد تستخدم كـ “غراء جزيئي”، إذ تُدرج عبر “كريسبر” كقوالب توجيه، فتوجه الخلية نحو دمج الـDNA الجديد، أو التعديل الدقيق بدقة، دون التسبب في تلف النطاق المحيط أو جينات أخرى.
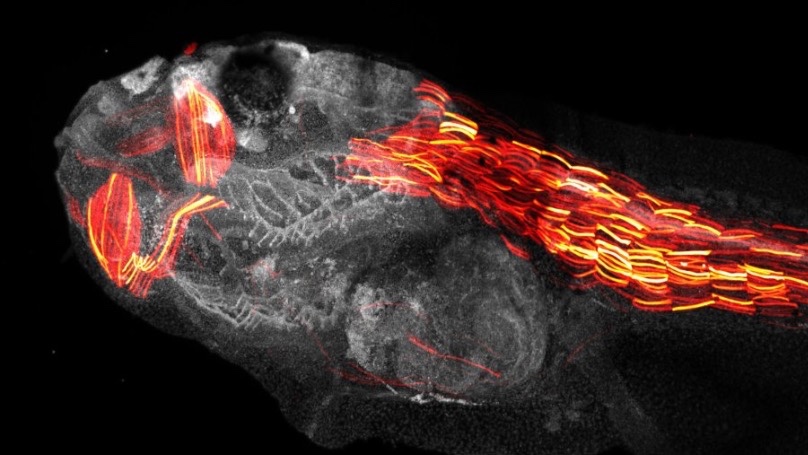
اختُبرت هذه القوالب المصممة بالذكاء الاصطناعي، على خلايا بشرية في المختبر، إذ أثبتت قدرتها على إدخال تعديلات جينية دقيقة ودمج جينات كاملة بكفاءة عالية. كما تم التحقق من فعاليتها على كائنات حية، منها الضفادع المستخدمة في الأبحاث الطبية، وفي فئران أُجريت فيها تعديلات على الحمض النووي لخلايا الدماغ بنجاح.
ويشير الباحث الرئيسي في الدراسة، توماس نيرت، إلى أن إصلاح الحمض النووي، يتبع أنماطاً متوقعة وليست عشوائية، وهو ما تستغله “بيثيا” لصالح الباحثين، حيث تمكن الفريق البحثي من محاكاة ملايين الاحتمالات لنتائج التعديل الجيني باستخدام التعلم الآلي، سعياً لإيجاد الطريقة الأكثر كفاءة لإحداث تعديل صغير محدد في الجينوم، وفقاً لآلية إصلاح الخلية المتوقعة.
ولا تقتصر فائدة التقنية على تغيير أحرف فردية في الشيفرة الجينية، أو دمج جينات خارجية، بل يمكنها أيضاً وسم بروتينات معينة بصبغات فلورية، ما يتيح مراقبة سلوكها في الأنسجة السليمة والمريضة. وتتميز الطريقة بقدرتها على العمل بكفاءة حتى في الأنسجة التي لا تنقسم خلاياها، مثل الدماغ.
سُميت الأداة “بيثيا” تيمناً بالكاهنة العليا في معبد “أبولو دلفي” اليوناني القديم، التي اشتهرت، وفق الأساطير اليونانية، بالتنبؤ بالمستقبل. ويشبّه المؤلف المشارك في الدراسة، سورين لينكامب، الأستاذ في معهد التشريح بجامعة زيورخ، دور “بيثيا” بعمل خبراء الأرصاد الجوية، قائلاً: “كما يستخدم خبراء الطقس الذكاء الاصطناعي للتنبؤ بالأحوال الجوية، نحن نستخدمه للتنبؤ بكيفية استجابة الخلايا للتدخلات الجينية. هذه القدرة التنبؤية أساسية لجعل التعديل الجيني آمناً وموثوقا وقابلا للتطبيق سريريا”.
كيف تعمل تقنية كريسبر؟
التعرف على تسلسل الحمض النووي المستهدف
يُصمَّم جزيء من الحمض النووي الريبي الموجه (gRNA) ليطابق تسلسلاً محدداً في الجين المطلوب تعديله.
ارتباط الجزيء الموجه بإنزيم “كاس 9”
يرتبط جزيءgRNA بإنزيم “كاس 9″، مكوّناً مركباً قادراً على البحث عن الموقع المستهدف في الحمض النووي.
البحث عن الموقع المستهدف في الجينوم
يتحرك مركب “كاس 9” و gRNA داخل الخلية لييبحث عن تسلسل الحمض النووي المطابق، مع التأكد من وجود إشارة PAM بجوار الموقع.
قطع الحمض النووي
عند العثور على التسلسل الصحيح، يقوم إنزيم “كاس 9” بعمل قطع مزدوج الشريط في الحمض النووي.
استجابة إصلاح الحمض النووي في الخلية
تبدأ الخلية بمحاولة إصلاح القطع باستخدام آليتين:
الإصلاح غير الموجه: ينتج غالباً طفرات عشوائية لتعطيل الجين.
الإصلاح الموجه : يستخدم قالب DNA جديد لإدخال تعديلات دقيقة أو استبدال الجين.
· الحصول على التعديل الجيني المطلوب
بعد الإصلاح، يكون الجين قد تم تعطيله أو تعديله حسب الهدف البحثي أو العلاجي
وتحول تلك اللأداة عملية التعديل الجيني من كونها عملية تخمينية إلى عملية قابلة للتنبؤ، تبدأ بقطع الحمض النووي بواسطة “كريسبر” ثم يقدر الذكاء الاصطناعي قالب الإصلاح الأمثل ويدخله، ليتم إصلاح الجينوم بدقة؛ ما يعزز السلامة والفعالية في تحرير الجينات، ما يجعلها خطوة أساسية نحو علاجات جينية أكثر دقة وأقل مخاطرة.
ويعتبر المؤلف المشارك في الدراسة، سورين لينكامب، أن أهمية العمل “لا تكمن في الأداة نفسها فحسب، بل في الإمكانات التي تفتحها، إذ تجمع بين التنبؤ واسع النطاق بالذكاء الاصطناعي والتجارب البيولوجية من الخلايا المزروعة إلى الكائنات الحية الكاملة، وهو ما يخلق فرصاً جديدة لفهم الأمراض الجينية وتطوير علاجات دقيقة، بما في ذلك أمراض الجهاز العصبي، بفعالية وأمان أكبر”.